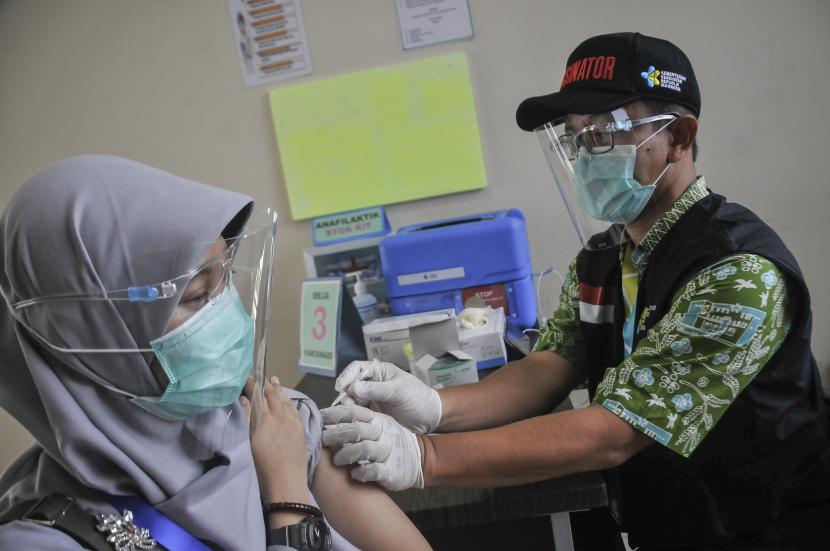
REPUBLIKA.CO.ID, JAKARTA -- Sebanyak 1.620 orang menjadi subjek penelitian uji klinik vaksin Covid-19 Sinovac di Bandung, Jawa Barat, dan prosesnya masih terus berjalan hingga hari ini. Sejauh ini, uji klinis vaksin tersebut masih aman dan belum menimbulkan efek samping pada relawan yang telah mendapatkan suntikan Vaksin Sinovac.
"Untuk sementara waktu dapat kami katakan uji klinik Vaksin Sinovac aman karena tidak terjadi hal-hal yang merugikan subjek," kata Ketua Tim Riset Uji Klinik Vaksin Covid-19 dari Universitas Padjadjaran (Unpad) Kusnandi Rusmil saat konferensi virtual bersama Badan Pengawas Obat dan Makanan (BPOM) serta Badan Usaha Milik Negara (BUMN) Penghasil Vaksin Bio Farma, Kamis (26/11).
Ia mengakui, 20 persen relawan sempat mengalami sedikit pilek kemudian pusing. Namun, keluhan ini hilang dalam waktu dua hari.
Pihaknya akan terus mengikuti perkembangan uji klinis sampai akhir penelitian. Kemudian pihaknya akan melaporkan hasil uji klinis tersebut ke BPOM.
"Kami mengharapkan dukungan semua pihak agar penelitian ini dapat berjalan dengan baik," ujarnya.
Ia menambahkan, sejak uji klinis dimulai Agustus 2020 lalu hingga sekarang terkumpul 1.620 orang sebagai relawan. Ribuan subjek itu telah mendapatkan suntikan pertama, kemudian sebanyak 1.603 orang mendapatkan injeksi kedua.
Selanjutnya, darah mereka akan diambil beberapa kali yaitu satu bulan setelah imunisasi kedua, tiga bulan setelah vaksin kedua, dan terakhir enam bulan setelah imunisasi ketiga.
Proses uji klinis kini dilakukan di enam tempat di antaranya Fakultas Kedokteran (FK) Unpad, Lembaga Biologi Molekuler (LBM) Eijkman, kemudian klinik kesehatan Unpad di Dipati Ukur, kemudian di pusat kesehatan masyarakat (Puskesmas) Garuda, termasuk Puskesmas Dago.
Hal serupa disampaikan Kepala Lembaga Biologi Molekuler Eijkman Amin Soebandrio. Dengan lolos uji klinis fase 1 dan 2, berarti kandidat vaksin Sinovac itu sudah memenuhi persyaratan terkait dengan keamanan dan efikasi dalam jumlah subjek penelitian terbatas.
"Intinya dengan sudah diizinkannya dia masuk ke fase 3 berarti fase 1 dan fase 2 sudah memenuhi persyaratan yaitu fase 1 terutama adalah hal 'safety' (keamanan) kemudian fase 2 'safety' dan 'eficacy' (efikasi) dalam jumlah yang terbatas," katanya kepada ANTARA, Jakarta, Kamis.
Ia mengatakan selama uji awal fase 1 dan fase 2 yang utamanya berkaitan dengan aspek keamanan dan efikasi vaksin, sudah dianggap memenuhi persyaratan dan dapat diterima hasilnya, maka boleh dilanjutkan ke uji klinis fase 3.
Uji klinis fase 1 dan 2 vaksin Sinovac dilakukan di China dan sudah selesai. Publikasi hasil uji klinis fase 1 dan 2 vaksin CoronaVac yang dibuat perusahaan asal China, Sinovac, terbit setelah beberapa bulan uji klinis fase 1 dan 2 selesai dilakukan.
Menanggapi hal itu, Amin mengatakan tidak selalu hasil fase-fase uji klinis dipublikasi secara lengkap. Hal yang penting, katanya, hasil uji klinis itu dilaporkan ke otoritas setempat di negara yang bersangkutan tempat uji klinis dilakukan, seperti Badan Pengawas Obat dan Makanan setempat (BPOM) sehingga BPOM setempat melakukan peninjauan dan evaluasi terhadap hasil itu.
Jika BPOM setempat sudah meninjau hasil uji klinis misalnya fase 1 dan hasilnya bisa diterima, maka bisa dilanjutkan ke fase berikutnya. Tentunya BPOM di setiap negara juga terikat pada satu standar. Mereka harus saling berkomunikasi dengan BPOM di seluruh negara terkait dengan suatu produk termasuk vaksin.
"Kalau misalnya suatu negara sudah menerbitkan izin misalnya untuk produknya tentu akan ditanya-tanya lagi berdasarkan apa saja, jadi antar BPOM akan saling berkomunikasi," tuturnya.